羧酸是一类来源广泛、价格低廉且可再生的化学原料,符合可持续化学转化的需求。羧酸基团在药物和天然产物中分布广泛,其后期官能团化反应具有重要应用价值。通过微调羧酸基团,可优化药物的关键药理性质(如溶解度、代谢稳定性和受体亲和力),从而加速药物发现;此外,通过改造天然产物骨架以开发具有新活性的衍生物,也可拓展天然产物的功能应用。
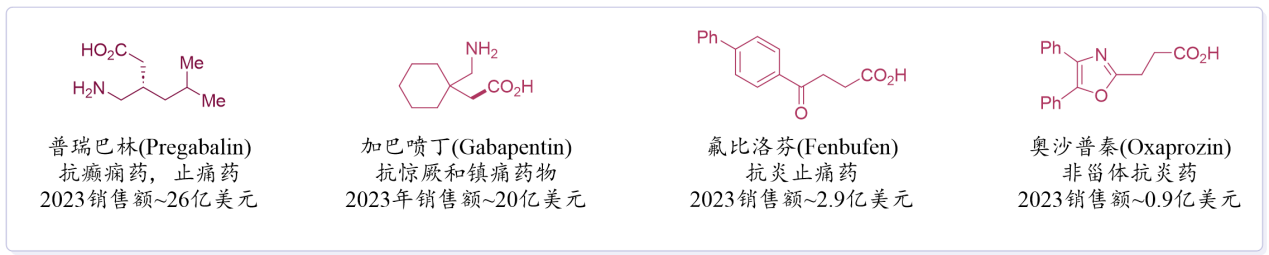
图1 羧酸药物与天然产物
然而,由于羧酸本身的高化学稳定性,这类反应通常依赖金属催化剂或光催化剂来降低反应能垒,并通过单电子转移(SET)机制实现脱羧偶联。光照和金属的使用虽然有效,但也增加了反应条件的苛刻性,使得羧酸类药物分子和天然产物的后期官能团化变得复杂且具有挑战性。近年来,研究表明,NADH类似物的电子-供体-受体(EDA)复合物在可见光激发下可以产生自由基,并与受体结合生成偶联产物(图1B)。虽然这一策略避免了金属催化剂的使用,但对光照的依赖依然是一个限制因素。在工业化应用中,光照需求不仅增加了设备复杂性,还提升了能源成本。因此,开发一种能够在温和、无光条件下实现羧酸后期官能团化的新策略,成为合成化学和药物化学中的一个关键课题。
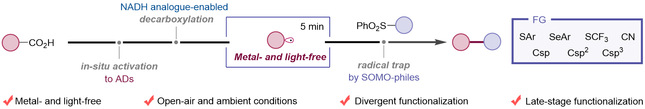
图2 非光照条件下NADH类似物促进的脱羧转化
针对上述挑战,清华大学深圳国际研究生院生物医药与健康工程研究院(以下称“iBHE”)毛润泽团队联合河南科技学院梁磊团队合作发展了一种温和条件下NADH类似物促进的羧酸药物与天然产物后期官能化策略。该反应体系操作简便(室温、无光照、无金属),将羧酸高碘酯(ADs),NADH模拟物和偶联试剂混合搅拌反应5分钟,即可实现羧酸基团的转化(图2)。反应还显示出了广泛的底物普适性,可用于氨基酸、药物分子及天然产物等生物活性分子的后期修饰,为生物活性分子化合物库的快速构建提供了一种高效的手段。
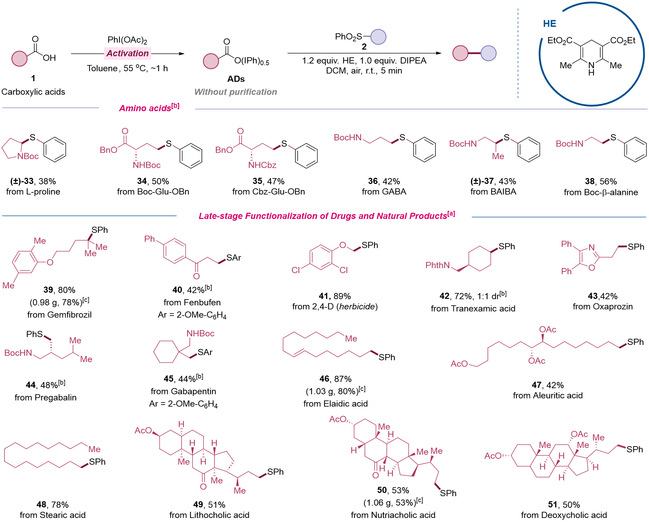
图3 生物活性分子的后期修饰
值得注意的是,通过使用其它类型的偶联试剂,原有反应体系还可以应用于其它多种化学键的构筑,包括C–X键(X = S、Se、SCF3和CN)、C–C(sp)键、C–C(sp²)键以及C–C(sp³)键(图4)。
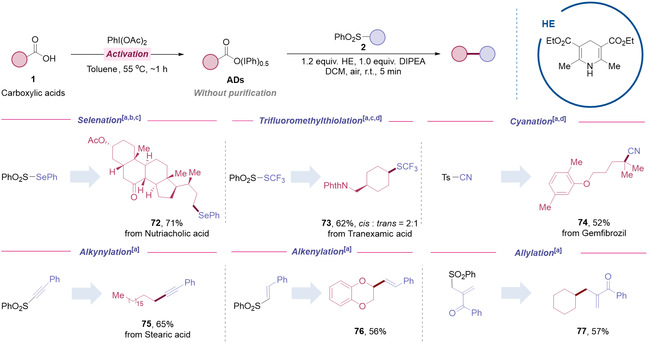
图4 多类型官能团转化
研究团队通过自由基捕获、自由基钟、环丙烷开环、关键中间体分离、密度泛函理论(DFT)计算和循环伏安法测试等手段对反应机理进行了研究,并提出了可能的反应机制。详细内容请参考原文。
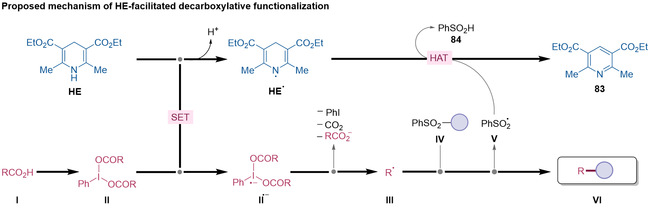
图5 提出的机理
相关研究以“NADH类似物实现无金属和无光的脱羧转化”(NADH Analogues Enable Metal- and Light-Free Decarboxylative Functionalization)为题发表在《德国应用化学》(Angewandte Chemie International Edition)上。该工作的通讯作者是iBHE助理教授毛润泽,第一作者是iBHE访问学者/河南科技学院副教授梁磊。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202415131
图/文:毛润泽
编辑:戴雨静
审核:陈超群


